Selpercatinibe em Pacientes com Carcinoma Medular de Tireoide Avançado e Mutação do RET
CÂNCER DE TIREOIDE
Rodolpho Pinto
10/22/20235 min read


Nesta semana, foi apresentado no Congresso Europeu de Oncologia Clínica (ESMO) o estudo LIBRETTO-531, mostrando a eficácia do selpercatinibe, um potente inibidor seletivo do gene RET, no tratamento do carcinoma medular de tireoide avançado. Será que teremos mudança no tratamento deste tumor? Confira abaixo como foi o estudo.
O carcinoma medular de tireoide (CMT) é uma neoplasia neuroendócrina que pode ser caracterizada pela mutação no gene RET. Esta mutação promove ativação constitutiva da proteína-quinase RET, promovendo crescimento e proliferação celular. A mutação do RET está associada a quase todas as neoplasias endócrinas múltiplas (NEM2A e NEM2B) e presente em até 50% dos casos de CMT esporádico. A mutação no gene RET M918T é a mais associada aos casos avançados de CMT. Tratamentos sistêmicos são utilizados em pacientes com doença estrutural com alto volume de doença e/ou progressão de doença.
Cabozantinibe e vandetanibe, dois inibidores da tirosino-quinase (TKI) são aprovados para o tratamento do CMT avançado sintomático e com progressão de doença. Apesar de eficazes, apresentam inibição inadequada em relação ao RET, efeitos adversos importantes relacionados a inibição de outros agentes, tempo de meia-vida longa (dificultando manejo) e resistência ao RET V804X.
O selpercatinibe é o primeiro inibidor seletivo do gene RET, mostrando resultados interessantes em estudos de fase 1 e 2 em pacientes com carcinoma medular de tireoide avançado. Porém, não havia estudos comparando esta medicação com a terapia de primeira linha (cabozantinibe ou vandetanibe).
Metodologia
Foi realizado um ensaio clínico randomizado multicêntrico aberto (fase 3), comparando selpercatinibe com as terapias de 1ª linha no CMT avançado e mutação no RET. Foram selecionados pacientes com idade a partir dos 12 anos, com CMT avançado e mutação no RET (somática ou germinativa), escala de performance-status (ECOG) 0 a 2, sem uso prévio de TKI. Os critérios de progressão foram avaliados de acordo com o RECIST, ao rastreio comparado com 14 meses anteriores. Os critérios de exclusão foram: pacientes com metástase para sistema nervoso central sintomáticos; doença cardiovascular ativa ou prévia; infecção sistêmica ativa; síndrome desabsortiva; tireoidopatia sem controle; distúrbios do cálcio; hemorragia ativa; outras neoplasias (não-melanoma).
Os pacientes foram pareados numa proporção de 2:1, entre selpercatinibe oral (160mg duas vezes ao dia), cabozantinibe oral (140mg uma vez ao dia) ou vandetaninbe oral (300mg uma vez ao dia).
O desfecho primário foi avaliar sobrevida livre de progressão e os desfechos secundários foram de avaliar eficácia e tolerabilidade nos pacientes usando selpercatinibe.
Quais os resultados?
Entre fevereiro de 2020 e março de 2023 foram selecionados 291 pacientes, sendo 193 no grupo selpercatinibe e 98 no grupo controle (73 pacientes usando cabozantinibe e 25 pacientes usando vandetanibe).
Cerca de 63% dos pacientes eram do sexo masculino, 73,8% tinham idade entre 18-65 anos e a mutação no RET M918T foi encontrada em 62,7% da amostra. Houve descontinuidade do tratamento em 9,3% no grupo selpercatinibe e 58,2% no grupo controle.
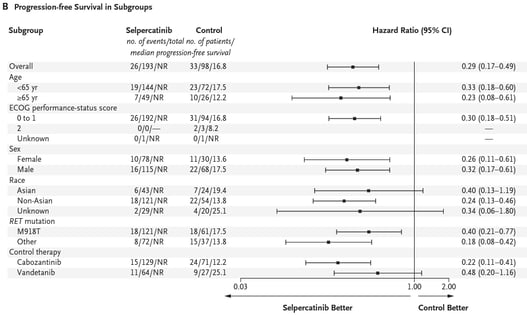
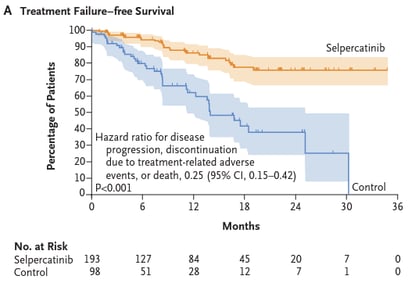
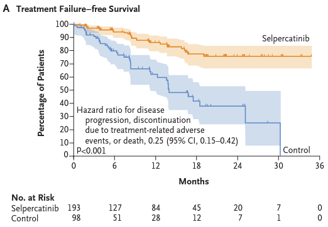
Houve redução na progressão de doença ou morte no grupo selpercatinibe em comparação com o grupo controle (HR 0,28, IC 95%, 0,16 a 0,48, p < 0,001). A taxa de sobrevida livre de progressão em 12 meses foi de 86,8% no grupo selpercatinibe (IC 95%, 79,8 a 91,6) contra 65,7% no grupo controle (IC 95%, 51,9 a 76,4).
A sobrevida livre de falha de tratamento em 12 meses foi maior no grupo selpercatinibe em comparação com o grupo controle (86,5% x 62,1%). A taxa de sobrevida em 15 meses também foi maior no grupo intervenção em comparação com o grupo controle (95,5% x 92,8%).
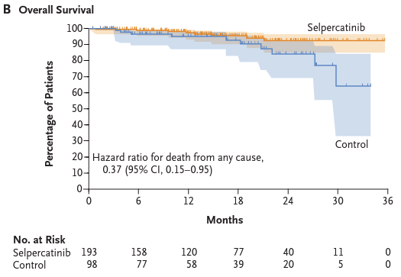
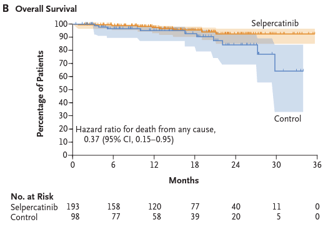
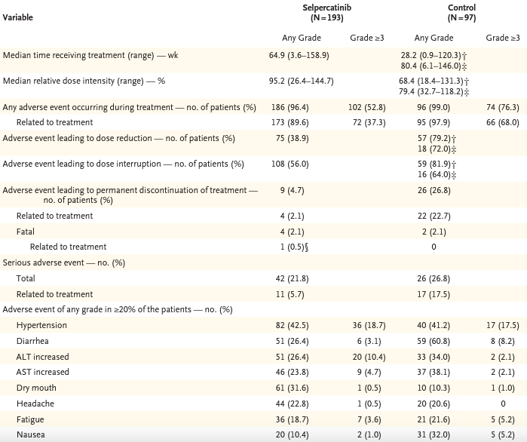
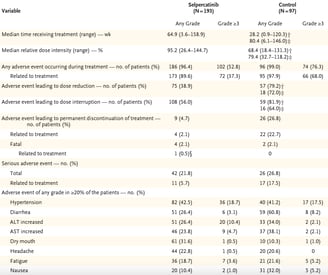
Efeitos adversos foram discretamente maiores no grupo controle em comparação com o grupo intervenção (99% x 96,4%). No grupo selpercatinibe, os principais foram hipertensão (42,5%), boca seca (31,6%) e diarreia/elevação de transaminases (26,4%). Eventos adversos graves ( ≥ grau 3) foram mais frequentes no grupo controle (76,3%) em comparação com o grupo selpercatinibe (52,8%). Foram relatados 4 casos (2,1%) de morte no grupo selpercatinibe e 2 casos (2,1%) no grupo controle.
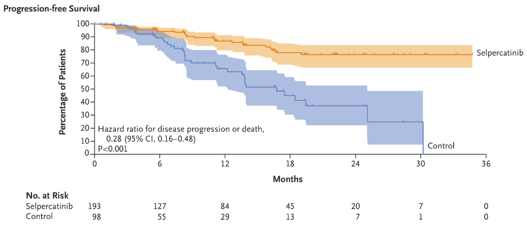
Efeitos adversos foram discretamente maiores no grupo controle em comparação com o grupo intervenção (99% x 96,4%). No grupo selpercatinibe, os principais foram hipertensão (42,5%), boca seca (31,6%) e diarreia/elevação de transaminases (26,4%). Eventos adversos graves ( ≥ grau 3) foram mais frequentes no grupo controle (76,3%) em comparação com o grupo selpercatinibe (52,8%). Foram relatados 4 casos (2,1%) de morte no grupo selpercatinibe e 2 casos (2,1%) no grupo controle.
Discussão
O estudo mostra que o uso de selpercatinibe foi mais eficaz em aumentar sobrevida livre de progressão em comparação com vandetanibe ou cabozantinibe, nos pacientes com CMT avançado e mutação do RET, e que nunca usaram TKI. Os benefícios também foram maiores no grupo selpercatinibe, com relação a sobrevida livre de falha de tratamento.
Podemos encontrar duas limitações no estudo: a primeira por não ser um estudo duplo-cego, estando sujeito a maior número de vieses; a segunda pela predominância de pacientes usando cabozantinibe no grupo controle.
O selpercatinibe já foi aprovado pelo FDA desde setembro de 2022 para uso nos pacientes com CMT com mutação no RET e doença locorregional ou a distância avançada. E agora, com a publicação dos dados do estudo LIBRETO-531, certamente deve se tornar a 1ª linha de tratamento nestes cenários.
Referências bibliográficas:
Wirth LJ, Brose MS, Elisei R, Capdevila J, Hoff AO, Hu MI, Tahara M, Robinson B, Gao M, Xia M, Maeda P, Sherman E. LIBRETTO-531: a phase III study of selpercatinib in multikinase inhibitor-naïve RET-mutant medullary thyroid cancer. Future Oncol. 2022 Sep;18(28):3143-3150. doi: 10.2217/fon-2022-0657