Survodutide em pacientes com MASH e fibrose hepática
DOENÇA HEPÁTICA GORDUROSA METABÓLICA
6/15/20244 min read
A esteato-hepatite associada à disfunção metabólica (MASH), anteriormente conhecida como esteato-hepatite não alcoólica (NASH), está associada ao aumento da morbidade e mortalidade. A prevalência da condição está aumentando globalmente, destacando a necessidade de tratamentos eficazes. A FDA aprovou condicionalmente o resmetirom, um agonista seletivo do receptor beta do hormônio tireoidiano, como a primeira farmacoterapia para MASH com fibrose hepática moderada a avançada. Os agonistas do receptor GLP-1 são uma opção promissora de tratamento, dado a frequência da coexistência da obesidade em pacientes com MASH. No entanto, os hepatócitos carecem de receptores GLP-1, sugerindo que o agonismo dual dos receptores de glucagon e GLP-1 pode ser mais eficaz. O survodutide é um novo agonista dual administrado semanalmente, mostrando promessas em estudos pré-clínicos e de fase 2 para obesidade e condições hepáticas.
Metodologia
Foi realizado um estudo multicêntrico, randomizado, duplo-cego, controlado por placebo, de fase 2 conduzido em 25 países. Os participantes elegíveis eram adultos com MASH confirmado por biópsia e fibrose estágio F1 a F3. O diagnóstico de MASH requeria um escore de atividade (NAS) de pelo menos 4, com pelo menos 1 ponto para inflamação lobular e balonização hepatocelular.
Critérios de Inclusão:
Idade de 18 a 80 anos
MASH confirmado por biópsia
Estágio de fibrose F1 a F3
NAS de pelo menos 4
Peso corporal estável (variação <5% entre biópsia histórica e randomização)
Conteúdo de gordura hepática de pelo menos 8% medido por MRI-PDFF
Rigidez hepática superior a 6.0 kPa medida por elastografia transitória
Critérios de exclusão:
Consumo significativo de álcool (>210 g por semana para homens e >140 g para mulheres por mais de 3 meses)
Uso de medicamentos associados a lesão hepática, esteatose ou esteato-hepatite nas 12 semanas anteriores ao início do estudo
Histórico de outras formas de doenças hepáticas crônicas
Os participantes foram randomizados em quatro grupos para receber 2.4 mg, 4.8 mg, 6.0 mg de survodutide ou placebo, administrados semanalmente por 48 semanas. O estudo consistiu em duas fases: uma fase de escalonamento rápido da dose por 24 semanas, seguida por uma fase de manutenção de 24 semanas. O desfecho primário foi avaliar a melhora histológica da MASH sem piora da fibrose. Os principais desfechos secundários foram: redução do conteúdo de gordura hepática; melhora na fibrose hepática; resolução de MASH; mudança das transaminases.
Resultados
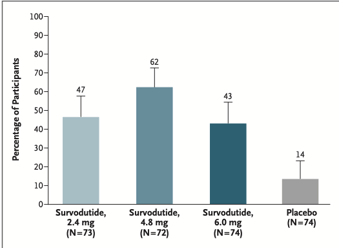
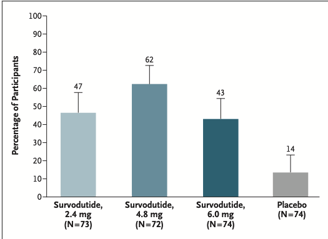
Um total de 295 foram randomizados para receber survodutide ou placebo. Houve melhora de MASH em 47% (2.4 mg), 62% (4.8 mg), e 43% (6.0 mg) dos participantes, comparados a 14% no grupo placebo. A redução do conteúdo de gordura hepática em pelo menos 30% foi observada em 63% (2.4 mg), 67% (4.8 mg), e 57% (6.0 mg) dos participantes, comparados a 14% no placebo. A melhoria na fibrose foi observada em 34%, 36%, e 34% dos participantes nos grupos de tratamento, respectivamente, comparados a 22% no placebo.
A resolução da MASH, definida como a ausência de balonização hepatocelular, inflamação lobular leve ou ausente e possível esteatose, foi observada em 49% dos participantes no grupo de 6.0 mg, em comparação a 11% no grupo placebo. A resolução da MASH com uma diminuição de pelo menos 2 pontos no escore de atividade de NAFLD e sem piora da fibrose foi observada em 39% dos participantes no grupo de 6.0 mg, em comparação a 5% no grupo placebo.
Resultados
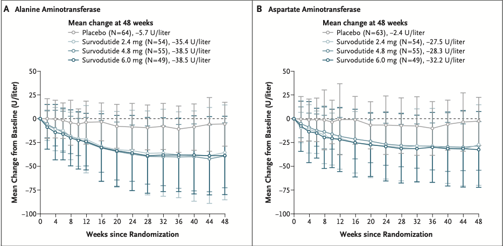
Houve uma redução significativa das transaminases nos grupos de tratamento com survodutide em comparação ao placebo. A mudança absoluta nos níveis de ALT no grupo de 6.0 mg foi de -38.5 U/L, enquanto no grupo placebo foi de -5.7 U/L. Para AST, a mudança foi de -32.2 U/L no grupo de 6.0 mg e -2.4 U/L no grupo placebo
Efeitos Adversos
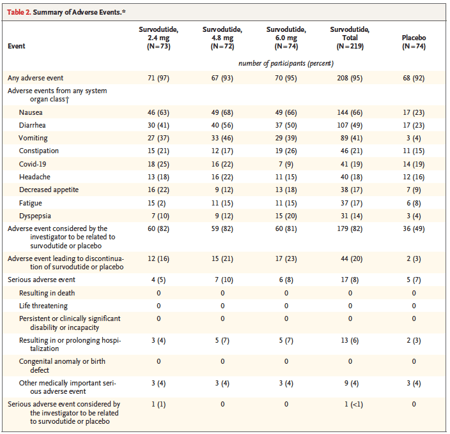
Os eventos adversos foram mais frequentes com o uso do survodutide em comparação ao placebo. Náusea foi relatada por 66% dos participantes no grupo de survodutide, em comparação a 23% no grupo placebo. Diarreia foi reportada por 49% dos participantes recebendo survodutide, comparado a 23% daqueles no grupo placebo. Vômitos ocorreram em 41% dos participantes do grupo survodutide, enquanto apenas 4% no grupo placebo relataram este efeito adverso. Eventos adversos graves foram observados em 8% dos participantes no grupo de survodutide e em 7% no grupo placebo, indicando que, embora a incidência de efeitos adversos não graves tenha sido significativamente maior com survodutide, os eventos adversos graves foram semelhantes entre os grupos.
Conclusão do Artigo
Survodutide mostrou-se superior ao placebo na melhora da MASH sem piora da fibrose, justificando investigações adicionais em estudos de fase 3.
Ponto de Vista
O survodutide representa um avanço potencial no tratamento de MASH com fibrose, especialmente considerando os benefícios combinados dos agonistas dos receptores de glucagon e GLP-1. Enquanto os agonistas do receptor GLP-1 são conhecidos por seus efeitos extra-hepáticos, como o controle glicêmico, a redução do apetite e a perda de peso, o agonismo do receptor de glucagon proporciona efeitos hepáticos diretos, incluindo aumento do gasto energético, lipólise e mobilização da gordura hepática. Esta dualidade de ações parece ser particularmente benéfica para pacientes com MASH.
No entanto, a alta incidência de efeitos adversos gastrointestinais sugere a necessidade de estratégias para melhorar a tolerabilidade, possivelmente através de ajustes na dose-escalonamento. Vamos aguardar o avanço em estudos de fase 3 e torcer para que os resultados sejam semelhantes. Quem sabe não teremos mudanças futuras no tratamento da doença hepática gordurosa metabólica.
Sanyal AJ, et. al. A Phase 2 Randomized Trial of Survodutide in MASH and Fibrosis. N Engl J Med. 2024